Nghiên cứu sản xuất và sử dụng chế phẩm sinh học để tách vỏ quả mắc ca
Mục tiêu của nghiên cứu này là nghiên cứu sản xuất và sử dụng chế phẩm sinh học để tách vỏ quả mắc ca. Sử dụng phương pháp khuếch tán đĩa thạch, phương pháp DNS, phương pháp định danh nấm mốc và định danh vi khuẩn, đã phân lập và tuyển chọn được 2 chủng nấm mốc VN06-F0329 (Aspergillus niger van Tieghem var), VN06-F0137 (Aspergillus oryzae) và 2 chủng vi khuẩn UL129 (Bacillus subtilis), UL005 (Bacillus subtilis) có hoạt tính CMC-ase cao để tách vỏ quả mắc ca. Xây dựng được quy trình tách vỏ quả mắc ca bằng công nghệ sinh học, với các thông số công nghệ, như sau: tỷ lệ chế phẩm sinh học 15%, thời gian lên men là 9 ngày, nhiệt độ lên men là 35oC và khi đó hiệu suất tách vỏ quả mắc ca đạt 67,42%.
1. MỞ ĐẦU
Cây mắc ca có tên khoa học là Macadamia, thuộc chi Macadamia, họ Proteaceae, được đưa vào trồng ở nước ta từ năm 1994, đến nay Việt Nam là nước đứng thứ 11 trong 17 nước có diện tích cây mắc ca lớn nhất trên thế giới [1, 2]. Nước ta đang đẩy mạnh trồng cây mắc ca ở một số vùng Tây Nguyên, Tây Bắc, diện tích trồng ngày càng được mở rộng. Mắc ca là loại quả giàu giá trị dinh dưỡng, có chứa nhiều vitamin, acid béo không no, protein và các chất khoáng. Trong protein của nhân mắc ca có hơn 20 loại acid amin, trong đó có 10 acid amin không thay thế…[3].Hàm lượng lipid trong nhân mắc ca chiếm khoảng 78,20%, trong đó acid béo không no chiếm 84% tổng lipid [1, 4]. Vỏ quả mắc ca khi già thường có màu xanh đậm, hoặc ngà vàng, trong đó có các thành phần dinh dưỡng như: glucid, protein, lipid, vitamin, pectin, chất khoáng, polyphenol... [5]. Hiện nay ở trong nước, việc tách vỏ quả mắc ca vẫn chủ yếu là dùng biện pháp thủ công, ở một số nước trồng nhiều mắc ca như Australia, Mỹ thường dùng máy [6]. Việc ứng dụng công nghệ sinh học để tách vỏ quả mắc ca thì đến thời điểm này rất ít các công trình đã công bố, tách vỏ quả mắc ca bằng công nghệ sinh học góp phần tạo cho sản phẩm mắc ca có màu sắc và mùi vị đặc trưng, thân thiện với môi trường. Mục tiêu của nghiên cứu này là nghiên cứu sản xuất và sử dụng chế phẩm sinh học để tách vỏ quả mắc ca, góp phần làm cơ sở cho việc ứng dụng vào thực tiễn.
2. NGUYÊN VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Nguyên vật liệu
2.1.1. Nguyên liệu
Quả mắc ca tươigiống 246 Keauhou, được thu hái ở thời điểm 195-215 ngày (tính từ khi đậu quả) tại 3 Trang trại trồng mắc ca của tỉnh Sơn La [5].
2.1.2. Các chủng vi sinh vật
Các chủng nấm mốc, vi khuẩn được phân lập và lưu giữ tại phòng Công nghệ enzyme-protein, Viện Vi sinh vật và Công nghệ Sinh học, Đại học Quốc gia Hà Nội. Sau đó được sử dụng để sàng lọc và lựa chọn các chủng có hoạt tính sinh học cao, thích hợp cho việc tách vỏ quả mắc ca bằng phương pháp lên men.
2.1.3. Môi trường nuôi cấy
Môi trường nuôi cấy vi khuẩn LB (Lysogeny broth) gồm có trypton 1%, cao nấm men 0,5%, NaCl 0,5%. Môi trường PDA (Potato dextrose agar) nuôi cấy nấm mốc bao gồm khoai tây 0,4%, dextrose 2%, agar 1,6%.Môi trường CMC (Carboxy methyl cellulose) gồm có thạch, tinh bột, cao nấm men, bột đậu tương, acid 3,5-dinitrosalicylic, gel Sephadex G-50, K-Na tartrate tetrahydrate, CaCO3, NaOH
2.2. Phương pháp nghiên cứu
2.2.1. Phương pháp xác định hoạt tính trên đĩa thạch
Cân thạch cho vào bình tam giác, thêm dung dịch đệm có pH thích hợp sao cho nồng độ thạch đạt 1,8%. Đun đến khi thạch tan hoàn toàn, cho NaNO2 đến nồng độ 0,02%. Sau đó hỗn hợp được đổ vào đĩa petri tạo thành một lớp thạch dày khoảng 0,3 cm. Để thạch nguội, đục thành các giếng có đường kính bằng nhau trên đĩa thạch. Chế phẩm sinh học được nhỏ vào các giếng thạch, ủ 37oC trong 4 giờ. Ở giếng đối chứng âm, nhỏ môi trường nuôi cấy không có chế phẩm sinh học. Hoạt tính enzyme được thể hiện qua vòng sáng quanh giếng.
2.2.2. Phương pháp xác định hoạt độ CMC-ase
Để xác định hoạt độ CMC-ase, sử dụng phương pháp DNS, tiến hành dựng đường chuẩn glucose như sau:Cân 0,5 g CMC hoà tan trong 40 ml đệm Tris-HCl 50 mM; pH 7,2 bằng khuấy từ gia nhiệt. Cho vào ống thí nghiệm 150 μl mẫu enzyme giữ 5 phút tại 50°C, sau đó bổ sung 150 μl cơ chất CMC 1% đã đạt nhiệt độ 50°C[7]. Đường glucose được sấy khô trong 5 giờ ở 80°C. Pha loãng đường glucose thành một dãy các nồng độ là: 0,08 mg/ml; 0,16 mg/ml; 0,32 mg/ml; 0,64 mg/ml; 1,28 mg/ml và 2,56 mg/ml. Lấy 300 µl dung dịch glucose ở các nồng độ trên và 900 ml dung dịch DNS cho vào ống eppendorf, đun sôi 5 phút, làm lạnh nhanh dưới vòi nước chảy và tiến hành so màu ở bước sóng 540 nm [7].Dựng đường chuẩn tương quan giữa nồng độ đường glucose và độ hấp thu được đo tại bước sóng 540 nm trong Microsoft Exel.
Hoạt độ CMC-ase được tính theo công thức: Hoạt độ (U/ml) = (CTN – CĐC). D/(T.V). Trong đó: CTN: số đọc từ đường chuẩn đường glucose của ống thí nghiệm, µmol/l; CĐC: số đọc từ đường chuẩn đường glucose của ống đối chứng, µmol/l; D: độ pha loãng của mẫu; V: thể tích mẫu của phản ứng (0,15 ml); T: thời gian phản ứng (30 phút) [7].
2.2.3. Phương pháp định danh nấm mốc
Để khuếch đại cho vùng trình tự ITS, có sự tổ hợp 2 vùng trình tự ITS4 và ITS5 trên máy Gene Amo PCR System 9700, với các chu trình nhiệt như sau: Giai đoạn đầu làm biến tính ADN thành sợi đơn ở 96oC trong vòng 10 giây, giai đoạn hai bắt các cặp mồi tìm đến bổ sung vào 2 đầu của ADN ở nhiệt độ 50oC trong 5 giây, giai đoạn ba nâng nhiệt độ lên 60oC trong 1 phút, kết thúc nhân đoạn AND thì nâng nhiệt độ lên 72oC trong 5 phút, sau đó giảm xuống 4oC và giữ mẫu ở nhiệt độ này. Mẫu được chuyển sang ống eppendoft 1,5 ml, thêm 5 µl EDTA 1,25M, thêm 60µl ethanol 100%. Trộn nhẹn hàng, giữ ở nhiệt độ phòng trong 15 phút. Ly tâm 15000 vòng/phút trong 10 phút. Rửa bằng 10 µl ethanol 70%, ly tâm 15000 vòng/phút trong 10 phút và làm khô mẫu bằng máy cô quay chân không trong 3-5 phút. Đun 1% agarose với 2ml dung dịch 50xTAE và 98 ml nước cất, đểnguội rồi đặt tấm gel vào trong máy điện di. Lấy 1µl dung dịch 6x đệm nhồi, trộn đều với 1 µl mẫu, nhỏ vào giếng. Chạy điện di bằng dòng điện một chiều với điện thế 100V, cường độ dòng điện 80 mA trong 30 phút, bỏ ra ngâm trong dung dịch ethidium bromua (nồng độ 0,5µl/ml) 20 phút rồi vớt ra quan sát [8, 9]. Các trình tự ADN được lắp ráp và chỉnh sửa thủ công bằng phần mềm BioEdit 7.09. Trình tự của mỗi gen được liên được liên kết với trình tự Gene Bank từ cơ sở dữ liệu NCBI.
2.2.4. Phương pháp định danh vi khuẩn
Tách chiết DNA tổng số được thực hiện theo phương pháp của Sambrook [10]. Gene 16S rRNA của chủng vi khuẩn được khuếch đại với cặp mồi đặc hiệu cho gene (27F: AGAGTTTGATCCTGGCTCAG và 1492R:
GGTTACCTTGTTACGACTT). Phản ứng gồm 5 µl hỗn hợp đệm (Tris- HCl 0,2 M, pH 8,3; KCl 0,25 M, MgCl2 20 mM), 20 nmol mỗi loại deoxynucleotide, 2,5 U Taq DNA polymerase và 1 µl DNA khuôn. Chu kỳ nhiệt cho phản ứng PCR: ở nhiệt độ 95ºC trong 5 phút, sau đó là chu kỳ (95ºC: 30s, 52ºC: 30s và 72ºC: 1 phút) và 72ºC: 7 phút. Sản phẩm PCR được phân tích bằng điện di trên gel agarose và được gửi đến hãng 1rst Base (Singapore) để xác định trình tự.Trình tự 16S rDNA được so sánh với trình tự đã có trên dữ liệu GenBank bằng cách sử dụng công cụ BLAST.Sau đó các trình tự này được sắp xếp tương ứng bằng cách sử dụng chương trình CLUSTAL-X phiên bản 1.8 [11].
2.2.5. Phương pháp thí nghiệm
Quá trình tách vỏ quả mắc ca được thực hiện bằng công nghệ sinh học, mỗi thí nghiệm được lặp lại 3 lần [12] và được thực hiện như sau:
Thí nghiệm 1: Ảnh hưởng của tỷ lệ chế phẩm sinh học đến quá trình tách vỏ quả mắc ca. Thí nghiệm được tiến hành trong điều kiện thời gian 9 ngày, nhiệt độ 32oC, tỷ lệ chế phẩm là 0%, 5%, 10%, 15% và 20%.
Thí nghiệm 2: Ảnh hưởng của thời gian lên men đến quá trình tách vỏ quả mắc ca. Tiến hành khảo sát các yếu tố nhiệt độ lên men 32oC, hàm lượng chế phẩm sinh học 15%, thời gian lên men 3 ngày, 6 ngày, 9 ngày, 12 ngày và 15 ngày.
Thí nghiệm 3: Ảnh hưởng của nhiệt độ lên men đến quá trình tách vỏ quả mắc ca. Khảo sát ở các điều kiện nồng độ chế phẩm sinh học là 15%, thời gian lên men là 9 ngày, chọn khoảng nhiệt độ lên men là 29oC, 31oC, 33oC, 35oC, 37oC và 39oC.
2.2.6. Phương pháp xác định hiệu suất tách vỏ quả mắc ca
Hiệu suất của quá trình tách vỏ quả mắc ca được thực hiện như sau:
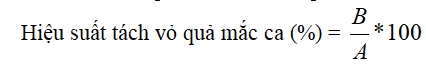
Trong đó: A- khối lượng quả mắc ca đưa vào tách vỏ, B- khối lượng quả mắc ca đã được tách vỏ.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Các chủng nấm mốc và vi khuẩn để tách vỏ quả mắc ca
3.1.1. Các chủng nấm mốc
3.1.1.1. Hoạt tính CMC-ase của các chủng nấm mốc
Bảy chủng nấm mốc đã qua sàng lọc sơ bộ được xác định hoạt tính CMC-ase trên đĩa thạch. Kết quả được trình bày ở bảng 3.1.
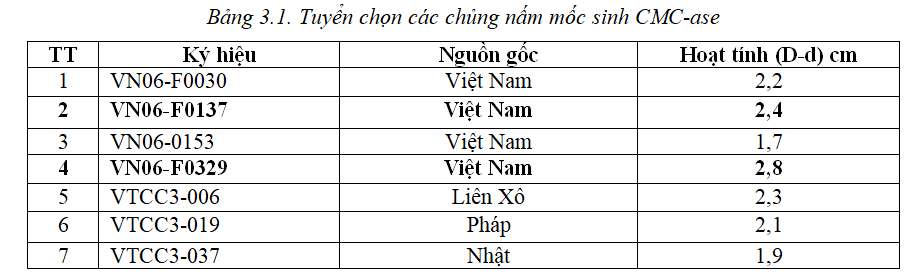
Kết quả cho thấy chủng VN06-F0137 và VN06-F0329 có đường kính vòng phân giải CMC lớn nhất và cả hai chủng này được tiếp tục sử dụng làm đối tượng nghiên cứu phân loại.
3.1.1.2. Định danh chủng nấm mốc VN06-F0137 và VN06-F0329
Dựa trên đặc điểm hình thái, cả hai chủng nấm mốc VN06-F0137 và VN06-F0329 đều được định danh là Aspergillus sp. Chủng nấm mốc VN06-F0137 là Aspergillus oryzae và chủng nấm mốc VN06-F0329 là Aspergillus niger van Tieghem var. Đây là những chủng an toàn để có thể sử dụng cho người/động vật. Trong hai chủng nấm mốc này thì chủng nấm mốc VN06-F0329 (Aspergillus niger van Tieghem var) có đường kính vòng phân giải CMC lớn hơn.
Đối với chủng VN06-F0137, tên loài là Aspergillus oryzae, ký hiệu VN06-F0137, nguồn gốc phân lậptừ đất, bảo quản ở -86oC, tâm khuẩn lạc có màu trắng, mép có các sợi tơ trắng. Chủng VN06-F0329, tên loài: Aspergillus niger van Tieghem var, ký hiệu là VN06-F0329, được phân lập từ thực phẩm lên men, bảo quản ở -86oC và tâm khuẩn lạc có màu đen, mép có các sợi tơ trắng.
3.1.2. Các chủng vi khuẩn
3.1.2.1. Hoạt tính CMC-ase của các chủng vi khuẩn
Các chủng vi khuẩn được sàng lọc hoạt tính CMC-ase trên đĩa thạch. Kết quả được trình bày ở bảng 3.2
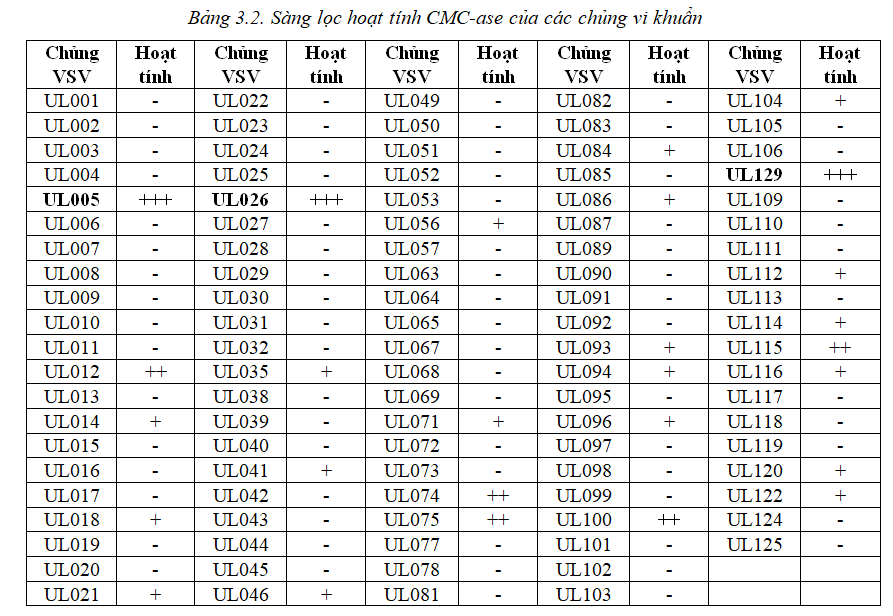
Dựa trên kết quả bảng 3.2, chủng UL005, UL026 và UL129 được sử dụng để xác định hoạt tính CMC-ase trên đĩa thạch và hoạt độ CMC-ase theo phương pháp đường khử. Kết quả xác định hoạt độ CMC-ase của các chủng nghiên cứu được thể hiện bảng 3.3.
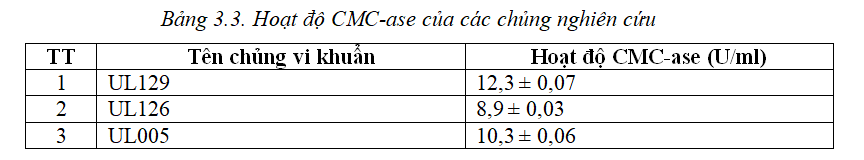
Kết quả trong bảng 3.3 cho thấy, chủng UL129 và chủng UL005 là hai chủng có hoạt độ CMC-ase cao.
3.1.2.2. Định danh chủng vi khuẩn
Kết quả nghiên cứu cho thấy chủng vi khuẩn UL005 và UL129 đều có hoạt tính CMC-ase cao, vì vậy cả hai chủng này được phân loại ở hình 3.1 và hình 3.2.
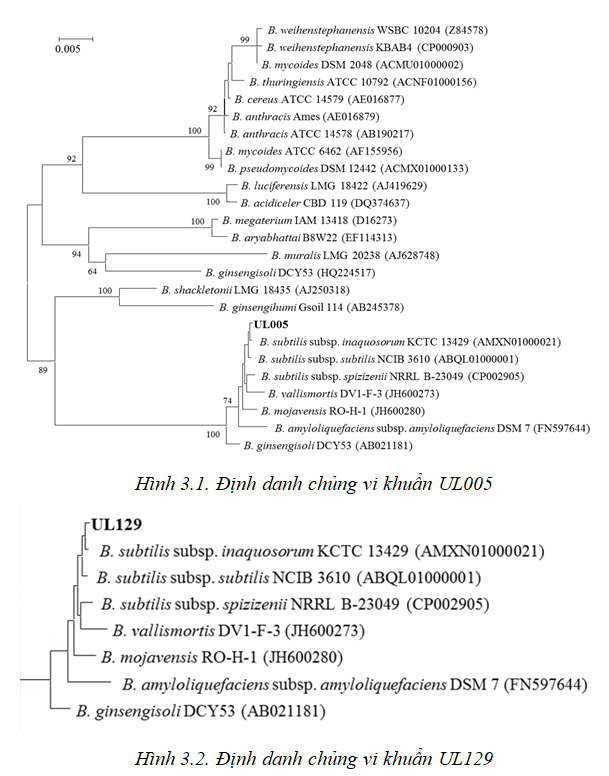

Dựa vào hình 3.1 và 3.2, chủng UL005 và UL129 đều được định danh là B. subtilis subsp, với độ tương đồng đạt 99,8%. Đây là chủng an toàn và hoàn toàn có thể sử dụng được cho người/động vật, chủngBacillus subtilis là các chủng vi sinh vật an toàn và sản phẩm của chúng được liệt kê vào danh mục các chất an toàn được dùng trong thực phẩm do cơ quan quản lý thực phẩm và dược phẩm Hoa kỳ và cơ quan quản lý an toàn thực phẩm châu Âu cho phép sử dụng. ChủngBacillus subtilis đã được sử dụng nhiều trong vai trò probiotic, là chủng vi khuẩn có hoạt tính CMC-ase.
Chủng UL129, với tên loài làBacillus subtilis, ký hiệu làUL129, nguồn gốc phân lập từ thịt chua Phú Thọ, chủng này được bảo ở nhiệt độ -86oC và khuẩn lạc có hình dạng hình tròn, mép hơi răng cưa, bề mặt sần, màu trắng, kích thước 2-3,0 mm, không tiết sắc tố ra môi trường.Chủng UL005, tên loài làBacillus subtilis, ký hiệu là UL005, được phân lập từ thực phẩm lên men, đây là vi khuẩn hiếu khí, được bảo quản ở nhiệt độ -86oC, khuẩn lạc lồi, có hình dạng hình tròn, mép hơi răng cưa, bề mặt sần, màu trắng, kích thước 2,5-3,0mm, không tiết sắc tố ra môi trường.
3.2. Các yếu tố ảnh hưởng đến quá trình tách vỏ quả mắc ca
Kết quả nghiên cứu thăm dò cho thấy có rất nhiều yếu tố ảnh hưởng đến quá trình lên men tách vỏ quả mắc ca, như nồng độ chế phẩm sinh học, nhiệt độ lên men, thời gian lên men, độ pH của môi trường, nồng độ cơ chất, thể tích của thiết bị lên men... Tuy nhiên có 3 yếu tố ảnh hưởng lớn nhất là nồng độ chế phẩm sinh học, nhiệt độ lên men và thời gian lên men. Do đó chọn các yếu tố này để thực hiện quá trình lên men tách vỏ quả mắc ca.
3.2.1. Ảnh hưởng của tỷ lệ chế phẩm sinh học đến hiệu suất tách vỏ quả mắc ca
Trong vỏ quả mắc ca, glucid chiếm hơn 8%, đặc biệt trong đó cellulose và pectin là những thành phần chiếm chủ yếu. Trong nội dung này sử dụng chế phẩm sinh học gồm có 2 chủng nấm mốc VN06-F0329 (Aspergillus niger van Tieghem var), VN06-F0137 (Aspergillus oryzae) và 2 chủng vi khuẩn UL129 (Bacillus subtilis), UL005 (Bacillus subtilis) có hoạt tính CMC-ase cao và được tuyển chọn để tách vỏ quả mắc ca bằng phương pháp lên men. Thí nghiệm được tiến hành trong điều kiện thời gian 9 ngày, nhiệt độ 32oC, tỷ lệ chế phẩm là 0%, 5%, 10%, 15% và 20%. Kết quả được thể hiện ở hình 3.3.
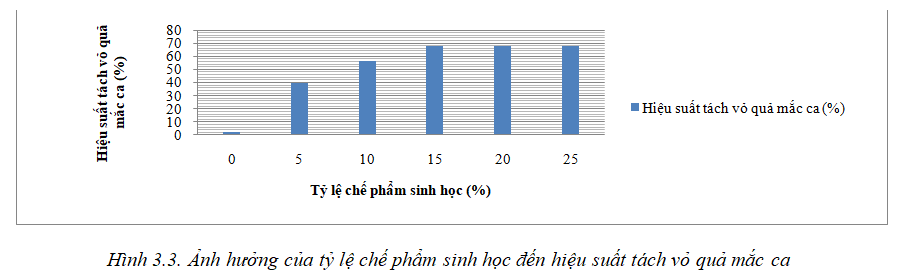
Quả mắc ca sau khi thu hoạch, tiến hành làm chày xước vỏ quả, sau đó ngâm vào chế phẩm sinh học. Kết quả cho thấy sau 9 ngày ngâm quả mắc ca ở công thức 0% chế phẩm, hiệu suất tách vỏ là 2,36% (hiện tượng tách vỏ này chủ yếu là do nấm mốc bên ngoài xâm nhập làm mềm vỏ và hiện tượng nứt vỏ tự nhiên). Quả mắc ca ở công thức 15% chế phẩm,hiệu suất tách vỏ quả là 67,53%; công thức 20% chế phẩm, hiệu suất tách vỏ quả mắc ca là 68,06% và công thức 25% chế phẩm,hiệu suất tách vỏ quả mắc ca là 68,78%. Quả mắc ca ở 3 công thức này đều có hiện tượng là vỏ quả chuyển từ màu xanh sang màu nâu và mềm dần. So sánh giữa 3 công thức là công thức 15% chế phẩm, công thức 20% chế phẩm và công thức 25% chế phẩm thì hiệu suất tách vỏ quả mắc ca ở 3 công thức này không có sự sai khác nhau nhiều. Vì vậy để tiết kiệm chi phí, chọn công thức 15% chế phẩm để thực hiện các nghiên cứu tiếp theo.
3.2.2. Ảnh hưởng của thời gian lên men đến hiệu suất tách vỏ quả mắc ca
Để xác định ảnh hưởng của thời gian lên men đến hiệu suất tách vỏ quả mắc ca, tiến hành khảo sát các yếu tố nhiệt độ lên men 32oC, tỷ lệ chế phẩm sinh học 15%, thời gian lên men 3 ngày, 6 ngày, 9 ngày, 12 ngày và 15 ngày. Kết quả xác định ảnh hưởng của thời gian lên men đến hiệu suất tách vỏ quả mắc ca được thể hiện ở hình 3.4.
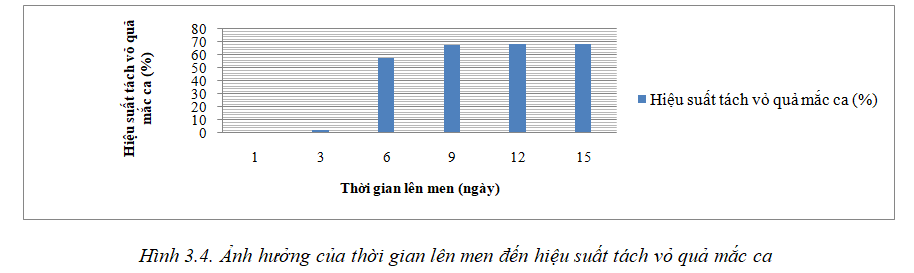
Kết quả nghiên cứu trong hình 3.4 cho thấy, đến ngày thứ 3 vỏ quả mắc ca có hiện tượng mềm dần, đặc biệt là ở những quả có độ chày xước mạnh, thời điểm này hiệu suất tách vỏ quả mắc ca chiếm 2,43% và đến ngày thứ 6 hiệu suất này tăng lên là 56,85%; đến ngày thứ 9 hiệu suất tách vỏ quả mắc ca 67,42%; đến ngày thứ 12 và 15 hiệu suất tách vỏ quả mắc ca tương ứng là 68,04% và 68,13%. So sánh giữa thời điểm 9 ngày, 12 ngày và 15 ngày thì hiệu suất tách vỏ quả mắc ca không có sự sai khác có ý nghĩa thống kê. Sở dĩ có hiện tượng này là ở thời gian dài, một số vi sinh vật đã bị chết, do đó làm giảm khả năng lên men của chế phẩm. Vậy để tiết kiệm thời gian và hạn chế sự biến đổi các thành phần dinh dưỡng trong nhân mắc ca, chọn thời điểm 9 ngày để thực hiện các nghiên cứu tách vỏ quả mắc ca.
3.2.3. Ảnh hưởng của nhiệt độ lên men đến hiệu suất tách vỏ quả mắc ca
Nhiệt độ cũng ảnh hưởng trực tiếp đến quá trình lên men, để tách vỏ quả mắc ca tiến hành khảo sát ở các điều kiện tỷ lệ chế phẩm sinh học là 15%, thời gian lên men là 9 ngày. Dựa vào kết quả nghiên cứu thăm dò, chọn khoảng nhiệt độ lên men là 29oC, 31oC, 33oC, 35oC, 37oC và 39oC. Kết quả được trình bày ở hình 3.5.
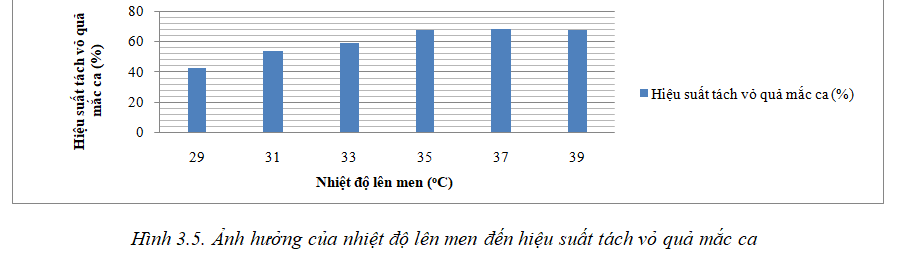
Dựa vào hình 3.5 cho thấy ở nhiệt độ 29oC, hiệu suất tách vỏ quả mắc ca đạt 42,07%; khi tăng nhiệt độ lên 31oC thì hiệu suất tách là 53,25%; nhiệt độ 33oC hiệu suất tách là 58,73%; nhiệt độ 35oC hiệu suất tách là 67,68%; nhiệt độ 37oC hiệu suất tách là 68,04% và khi tăng nhiệt độ lên 39oC thì hiệu suất tách vỏ quả mắc ca có xu hướng giảm xuống là 67,29%. Sở dĩ có hiện tượng này là khi nhiệt độ tăng quá cao sẽ ức chế sự hoạt động của các chủng vi sinh vật, từ đó làm giảm khả năng lên men của chế phẩm. So sánh 3 mức nhiệt độ 35oC, 37oC và 39oC, kết quả cho thấy hiệu suất tách vỏ mắc ca ở 3 mức nhiệt độ này không có sự chệnh lệch nhiều. Vì vậy chọn mức nhiệt độ 35oC để thực hiện các nghiên cứu tiếp theo.
3.3. Quy trình tách vỏ quả mắc ca
3.3.1. Sơ đồ quy trình tách vỏ quả mắc ca
Từ các kết quả nghiên cứu ở trên, đưa ra sơ đồ quy trình tách vỏ quả mắc ca bao gồm các bước như sau:
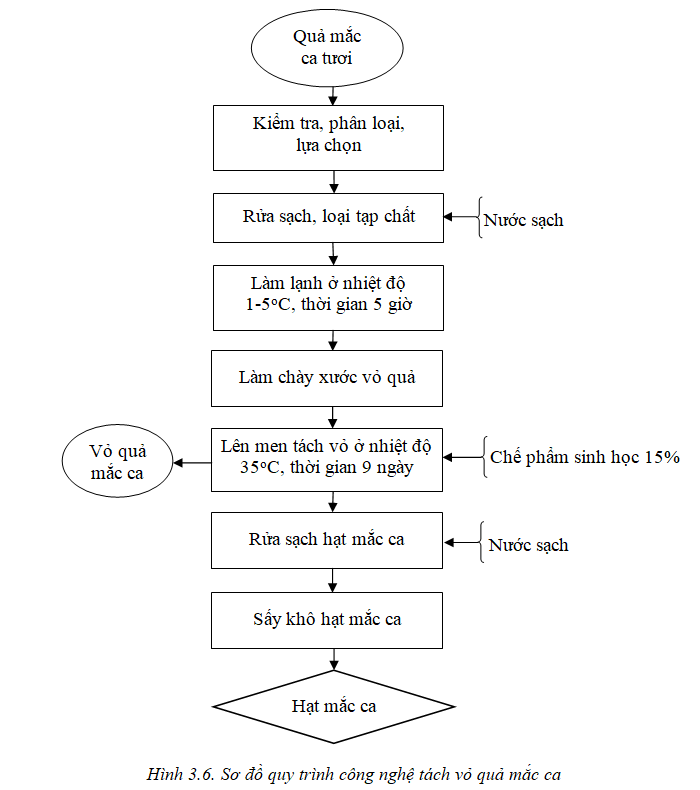
3.3.2. Thuyết minh quy trình tách vỏ mắc ca
Bước 1. Lựa chọn nguyên liệu:Quả mắc ca tươi giống 246 Keauhou, được thu hái ở thời điểm 195-215 ngày (tính từ khi đậu quả), lựa chọn những quả không bị sâu bệnh, không bị dị tật. Ở thời điểm này vỏ quả mắc ca chuyển sang màu xanh đậm, hoặc ngà vàng và thường hay bị nứt vỏ.
Bước 2. Rửa sạch loại tạp chất: Quả mắc ca sau khi lựa chọn, đem rửa sạch để loại tạp chất bẩn bám trên vỏ quả. Đổ trực tiếp quả mắc ca vào chậu, xả đầy nước, đảo đều và rửa sạch, sau đó vớt ra rổ để ráo nước. Lưu ý nước dùng để rửa quả mắc ca phải là nước sạch, đảm bảo các tiêu chuẩn nước dùng trong công nghiệp thực phẩm.
Bước 3. Làm lạnh sơ bộ: Quả mắc ca được đưa vào làm lạnh sơ bộ ở nhiệt độ 1- 4oC, với thời gian 5 giờ. Mục đích của quá trình này là làm cho các phân tử nước của vỏ quả mắc ca chuyển từ trạng thái ở nhiệt độ thường sang trạng thái nhiệt độ thấp gần điểm đóng băng, sẽ giãn nở tăng thể tích và phá vỡ cấu trúc của vỏ quả, từ đó tạo điều kiện thuận lợi cho quá trình lên men tách vỏ quả mắc ca.
Bước 4. Làm chày xước vỏ quả: Sau thời gian làm lạnh, vỏ quả được lấy ra ngoài, để đưa về nhiệt độ bình thường và làm chày xước toàn bộ vỏ quả. Quá trình làm chày xước vỏ quả được thực hiện bằng biện pháp cơ học như dùng máy chà để làm chày xước. Mục đích của quá trình làm chày xước vỏ quả là tạo các vết tổn thương trên vỏ quả tạo điều kiện thuận lợi cho chế phẩm sinh học dễ thấm vào vỏ quả và thủy phân vỏ quả, từ đó tiết kiệm được thời gian tách vỏ quả.
Bước 5. Lên men tách vỏ quả mắc ca: Quả mắc ca sau khi được làm chày xước, chuyển vào thùng chứa, đổ chế phẩm sinh học vào quả mắc ca, với lượng chế phẩm sinh học sử dụng là 15%; sau đó đậy nắp thùng, duy trì nhiệt độ lên men là 35oC và thời gian lên men là 9 ngày. Trong thời gian này vỏ quả mắc ca mềm dần và tách ra khỏi hạt mắc ca.
Bước 6. Rửa sạch hạt mắc ca: Quả mắc ca, sau khi tách vỏ, đem rửa sạch hạt và để ráo nước.Đổ trực tiếp hạt mắc ca vào chậu, xả đầy nước, đảo đều và rửa sạch các lớp dịch nhớt còn bám trên vỏ hạt, sau đó vớt ra rổ để ráo nước.
Bước 7. Sấy khô và thu hồi hạt mắc ca:Sấy khô hạt mắc ca ở 4 giai đoạn, giai đoạn 1 sấy ở nhiệt độ 38oC với thời gian là 24 giờ; giai đoạn 2 sấy ở nhiệt độ 45oC với thời gian 24 giờ và giai đoạn 3 nâng nhiệt lên 50oC với thời gian là 24 giờ, giai đoạn 4 sấy ở nhiệt độ 55oC với thời gian là 48 giờ, ở thời điểm này độ ẩm trong hạt mắc ca đạt dưới 12%. Hạt mắc ca sau khi được làm nguội đến nhiệt độ bình thường thì đưa vào bao bì PE bao gói kín và bảo quản ở nhiệt độ từ 12- 15oC.
4. KẾT LUẬN
Mục tiêu của nghiên cứu này là nghiên cứu sản xuất sử dụng chế phẩm sinh học để tách vỏ quả mắc ca. Đã phân lập và tuyển chọn được 2 chủng nấm mốc VN06-F0329 (Aspergillus niger van Tieghem var), VN06-F0137 (Aspergillus oryzae) và 2 chủng vi khuẩn UL129 (Bacillus subtilis), UL005 (Bacillus subtilis) có hoạt tính CMC-ase cao để tách vỏ quả mắc ca. Xây dựng được quy trình tách vỏ quả mắc ca bằng công nghệ sinh học, với các thông số công nghệ là tỷ lệ chế phẩm sinh học 15%, thời gian lên men là 9 ngày và nhiệt độ lên men là 35oC, khi đó hiệu suất tách vỏ quả mắc ca đạt 67,42%.
TÀI LIỆU THAM KHẢO
1. Hoàng Hòe (2015). Ngành công nghiệp Mắc ca trên thế giới và những bài học cho Việt Nam. Nhà xuất bản Nông nghiệp, 7-10.
2. Nguyễn Công Tạn (2005). Kỹ thuật đơn giản trồng cây mắc ca ở Việt Nam. Nhà xuất bản Nông nghiệp.
3. American Journal of Botany95, 84-89.
4. Hays M. (2001). Macadamia nuts. American Journal of Botany,95 (7), 843- 870.
5. Xác định thành phần hóa học của quả mắc ca thu hoạch ở các thời điểm khác nhau. Tạp chí Nông nghiệp và Phát triển nông thôn, 22, 78-82.
6. Lê Tùng Anh (2015). Công nghệ sau thu hoạch, tách vỏ, bảo quản, sơ chế và chế biến mắc ca. Kỷ yếu Hội nghị chiến lược phát triển cây mắc ca tại Tây Nguyên, 117-121.
7. Ghose T. K (1987). Measurement of cellulase activities. Pure and Applied Chemistry, 59(2), 257-268.
8. Saitou N, Nei M (1987). The neighbor- joining method: a new method for reconstructing phylogenetic trees. Molecular Bilogyand Evolution 4, 406-425.
9. Felsen SJ (1985). Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39, 783-791.
10. Sambrook J, Russell DW (2001). Molecular cloning: A laboratory manual, 3rd ed, Cold Spring Harbor Laboratory, Cold Spring Harbor, 62-65.
11.Thomson CJ, Seto H (1995). Gentics and biochemistry of antibiotic production. Butterworth- Heinemann, Boston, London, Oxford, Singapore, Syndey, Toronto, Wellington, 197- 222.
12.Nguyễn Văn Lợi, Bùi Thanh Bình, Bùi Xuân Đông (2017). Tối ưu hóa quá trình tách dầu mắc ca bằng phương pháp thủy phân enzyme. Tạp chí Hóa học, 55(4E23), 250-255.
Bài viết thuộc đề tài nghiên cứu "Sản xuất một số loại thực phẩm và thức ăn chăn nuôi từ quả mắc ca" thuộc Đề án Phát triển và ứng dụng công nghệ sinh học trong công nghiệp chế biến đến năm 2020 do Nạp Tiền 188bet chủ trì, giao Trường Đại học Công nghiệp Hà Nội thực hiện.
Nguyễn Văn Lợi
Trường Đại học Công nghiệp Hà Nội









